GMO: n viljely- ja monistuspakkaus
ominaisuudet
■ Laaja soveltuvuus: Tämä sarja voi poimia korkealaatuista genomista DNA: ta viidestä suuresta GMO -viljelykasvista.
■ Yksinkertaista ja nopeaa: GMO -viljelyn genomisen DNA: n uuttaminen voidaan suorittaa 2 tunnin kuluessa. Ei tarvita suuria jäähdytyssentrifugeja, alhaiset vaatimukset laitteille ja laitteille. Soveltuu GMO -viljelykasvien nopeaseen genomisen DNA -uuttamiseen kaikilla tutkimuslaitosten tasoilla.
■ Korkea hyötysuhde ja spesifisyys: Vasta-aineen modifioidun Taq-polymeraasin ainutlaatuinen puskuri varmistaa tehokkaan polymeraasin monistuksen, joka on spesifisempi kuin normaali Taq-polymeraasi.
Sovellukset
Pakkaus voi poimia korkealaatuista genomista DNA: ta suurista GMO -kasveista, kuten vehnästä, maissista, riisistä, puuvillasta ja soijapavusta, ja suorittaa siirtogeenisen PCR -havainnon GMO -viljelykasveista.
Kaikki tuotteet voidaan räätälöidä ODM/OEM: lle. Yksityiskohtia varten,napsauta Mukautettu palvelu (ODM/OEM)
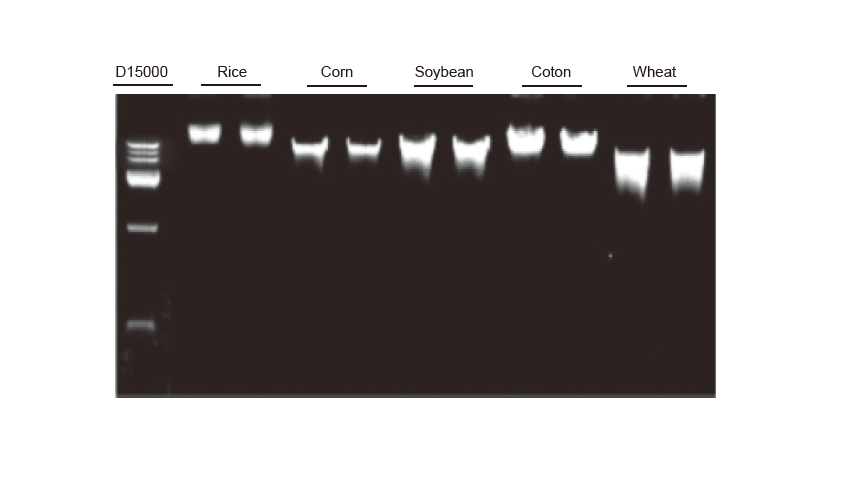 |
Genomisen DNA: n uuttaminen Genominen DNA -uutto suoritettiin 100 mg riisin, maissin, soijapapun, puuvillan ja vehnän lehdille. Koe toistettiin kahdesti. 3 μl DNA: ta 100 μl: n eluentista ladattiin kaistaa kohti. Agaroosigeelin pitoisuus oli 2%. Elektroforeesi suoritettiin alle 6 V/cm 20 minuutin ajan. D15000: TIANGEN D15000 DNA -merkki. |
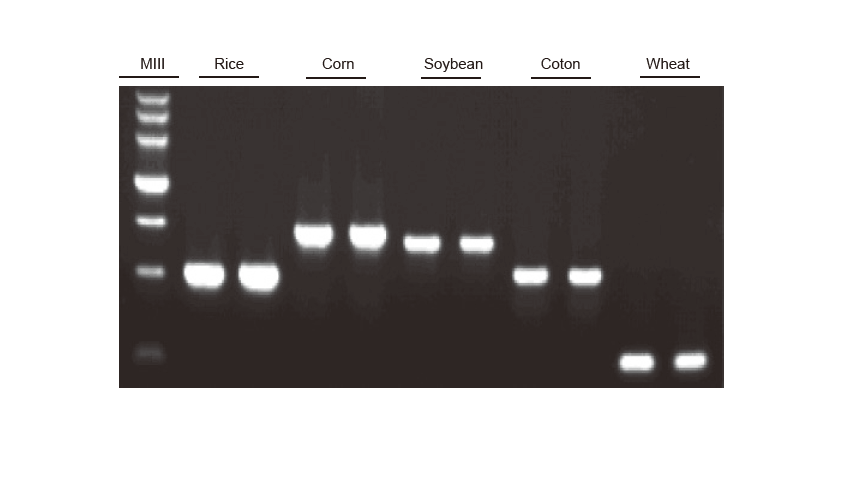 |
PCR -tunnistus Riisin, maissin, soijapapun, puuvillan ja vehnän genominen DNA monistettiin vastaavasti. Koe toistettiin kahdesti. 6 μl koko 20 μl reaktiojärjestelmästä ladattiin kaistaa kohti. Agaroosigeelin pitoisuus oli 2%. Elektroforeesi suoritettiin alle 6 V/cm 20 minuutin ajan. D15000: TIANGEN D15000 DNA -merkki. |
A-1-malli
■ Malli sisältää proteiiniepäpuhtauksia tai Taq -estäjiä jne. - Puhdista DNA -templaatti, poista proteiiniepäpuhtaudet tai poista templaatin DNA puhdistussarjoilla.
■ Mallin denaturointi ei ole valmis — - Nosta denaturoitumislämpötilaa asianmukaisesti ja pidennä denaturointiaikaa.
■ Mallin huonontuminen-Valmistele malli uudelleen.
A-2 Pohjamaali
■ Alukkeiden huono laatu-syntetisoi aluke uudelleen.
■ Alukkeen hajoaminen —— Liuotetaan suuripitoiset alukkeet pieneen tilavuuteen säilyttämiseksi. Vältä moninkertaista jäätymistä ja sulamista tai pitkäaikaista 4 ° C: n kylmäsäilytystä.
■ Alukkeiden väärä suunnittelu (esim. Alukkeen pituus ei ole riittävä, dimeeri on muodostettu alukkeiden väliin jne.) -Suunnittele alukkeet uudelleen (vältä alukkeen dimeerin ja toissijaisen rakenteen muodostumista)
A-3 Mg2+keskittymistä
■ Mg2+ pitoisuus on liian alhainen —— Nosta Mg oikein2+ pitoisuus: Optimoi Mg2+ pitoisuus 1 - 3 mM: n reaktiosarjoilla 0,5 mM: n välein optimaalisen Mg: n määrittämiseksi2+ pitoisuus kullekin templaatille ja alukkeelle.
A-4 Hehkutuslämpötila
■ Korkea hehkutuslämpötila vaikuttaa pohjamaalin ja templaatin sitoutumiseen. - Pienennä hehkutuslämpötilaa ja optimoi tila 2 ° C: n gradientilla.
A-5 Jatkoaika
■ Lyhyt jatkoaika —— Pidennä pidennysaikaa.
Ilmiöt: Negatiiviset näytteet osoittavat myös kohdesekvenssikaistat.
A-1 PCR: n kontaminaatio
■ Kohdasekvenssin tai monistustuotteiden ristikontaminaatio - Älä varovasti pipetoimalla näytettä, joka sisältää kohdesekvenssin negatiiviseen näytteeseen, tai läikyttämästä niitä ulos sentrifugiputkesta. Reagenssit tai laitteet on autoklavoitava olemassa olevien nukleiinihappojen poistamiseksi, ja kontaminaation olemassaolo on määritettävä negatiivisilla kontrollikokeilla.
■ Reagenssien likaantuminen ——Aliquot reagenssit ja säilytä alhaisessa lämpötilassa.
A-2 Primer
■ Mg2+ pitoisuus on liian alhainen —— Nosta Mg oikein2+ pitoisuus: Optimoi Mg2+ pitoisuus 1 - 3 mM: n reaktiosarjoilla 0,5 mM: n välein optimaalisen Mg: n määrittämiseksi2+ pitoisuus kullekin templaatille ja alukkeelle.
■ Virheellinen alukemalli ja kohdesekvenssi on homologinen ei-kohdesekvenssin kanssa. —— Suunnittele alukkeet uudelleen.
Ilmiöt: PCR-monistuskaistat ovat ristiriidassa odotetun koon kanssa, joko suuria tai pieniä, tai joskus esiintyy sekä spesifisiä monistuskaistoja että epäspesifisiä monistuskaistoja.
A-1 Pohjamaali
■ Alukkeiden heikko spesifisyys
——Uudelleensuunnittele aluke.
■ Alukkeen pitoisuus on liian korkea —— Nosta denaturointilämpötilaa oikein ja pidennä denaturointiaikaa.
A-2 Mg2+ keskittymistä
■ Mg2+ pitoisuus on liian korkea —— Pienennä Mg2+ -pitoisuutta oikein: Optimoi Mg2+ pitoisuus 1 - 3 mM: n reaktiosarjoilla 0,5 mM: n välein optimaalisen Mg: n määrittämiseksi2+ pitoisuus kullekin templaatille ja alukkeelle.
A-3 Lämpöstabiili polymeraasi
■ Liiallinen entsyymimäärä - Vähennä entsyymimäärää asianmukaisesti 0,5 U: n välein.
A-4 Hehkutuslämpötila
■ Hehkutuslämpötila on liian alhainen —— Nosta lämpöä sopivasti tai ota käyttöön kaksivaiheinen hehkutusmenetelmä
A-5 PCR-sykliä
■ Liian monta PCR -sykliä - Vähennä PCR -syklien määrää.
A-1 Pohjamaali——Huono spesifisyys —— Suunnittele alusta uudelleen, muuta alukkeen sijaintia ja pituutta parantaaksesi sen spesifisyyttä; tai suorittaa sisäkkäisen PCR: n.
A-2-malli DNA
- - Malli ei ole puhdas - - Puhdista templaatti tai poista DNA puhdistussarjoilla.
A-3 Mg2+ keskittymistä
- Mg2+ pitoisuus on liian korkea - vähennä Mg -määrää oikein2+ pitoisuus: Optimoi Mg2+ pitoisuus 1 - 3 mM: n reaktiosarjoilla 0,5 mM: n välein optimaalisen Mg: n määrittämiseksi2+ pitoisuus kullekin templaatille ja alukkeelle.
A-4 dNTP
——DNTP: iden pitoisuus on liian korkea ——Pienennä dNTP: n pitoisuutta asianmukaisesti
A-5 Hehkutuslämpötila
——Liian alhainen hehkutuslämpötila ——Korota hehkutuslämpötila asianmukaisesti
A-6 sykliä
——Liian monta sykliä ——Optimoi syklin numero

Ensimmäinen askel on valita sopiva polymeraasi. Säännöllistä Taq-polymeraasia ei voida oikolukuuttaa 3'-5'-eksonukleaasiaktiivisuuden puutteen vuoksi, ja epäsuhta heikentää huomattavasti fragmenttien pidennystehokkuutta. Siksi tavallinen Taq -polymeraasi ei voi tehokkaasti monistaa kohdefragmentteja, jotka ovat suurempia kuin 5 kb. Taq -polymeraasi, jolla on erityinen muunnos tai muu korkean tarkkuuden polymeraasi, tulisi valita parantamaan laajentamisen tehokkuutta ja vastaamaan pitkän fragmentin monistamisen tarpeisiin. Lisäksi pitkien fragmenttien monistaminen edellyttää myös vastaavaa säätöä alukkeen rakenteesta, denaturointiajasta, pidennysajasta, puskurin pH: sta jne. Yleensä alukkeet, joilla on 18-24 emäsparia, voivat johtaa parempaan saantoon. Templaatin vaurioitumisen estämiseksi denaturointiaika 94 ° C: ssa on lyhennettävä 30 sekuntiin tai alle jaksoa kohden ja lämpötilan nousemisen 94 ° C: een ennen monistusta on oltava alle 1 minuutti. Lisäksi pidennyslämpötilan asettaminen noin 68 ° C: een ja pidennysajan suunnitteleminen nopeuden 1 kb/min mukaan voi varmistaa pitkien fragmenttien tehokkaan monistumisen.
PCR -monistuksen virhetasoa voidaan pienentää käyttämällä erilaisia DNA -polymeraaseja erittäin tarkasti. Kaikkien tähän mennessä löydettyjen Taq DNA -polymeraasien joukossa Pfu -entsyymillä on alhaisin virhetaso ja suurin uskollisuus (katso oheinen taulukko). Entsyymivalinnan lisäksi tutkijat voivat edelleen vähentää PCR -mutaatiota optimoimalla reaktio -olosuhteita, mukaan lukien puskurikoostumuksen optimointi, lämpöstabiilin polymeraasin pitoisuus ja PCR -syklin lukumäärän optimointi.
Tuoteryhmät
MIKSI VALITA MEIDÄT
Tehtaamme on perustamisestaan lähtien kehittänyt maailmanluokan tuotteita periaatteen mukaisesti
ensin laatu. Tuotteemme ovat saaneet erinomaisen maineen alalla ja arvostusluottamuksen uusien ja vanhojen asiakkaiden keskuudessa.








