FastKing One Step RT-PCR -sarja
ominaisuudet
■ Puhtaus: Käänteiskopiointi- ja PCR -reaktiot suoritetaan yhdessä vaiheessa ristikontaminaation välttämiseksi.
■ Korkea hyötysuhde: Ainutlaatuinen King -käänteiskopioijaentsyymi, jonka RT -hyötysuhde on yli 95%.
■ Arkaluontoinen: Vain 1 ng malleja voidaan tunnistaa tarkasti, varsinkin jos malleja on vähän.
■ Spesifisyys: Vasta-aineella modifioitu Taq-polymeraasi parantaa edelleen monistustehokkuutta ja spesifisyyttä.
Sovellukset
Se soveltuu geenien ilmentymistason havaitsemiseen soluissa ja kudoksissa, tiettyjen geenien cDNA: n kloonaamiseen ja RNA -viruksen havaitsemiseen. Se soveltuu erityisesti alhaisen runsauden mallien laadulliseen havaitsemiseen.
Kaikki tuotteet voidaan räätälöidä ODM/OEM: lle. Yksityiskohtia varten,napsauta Mukautettu palvelu (ODM/OEM)
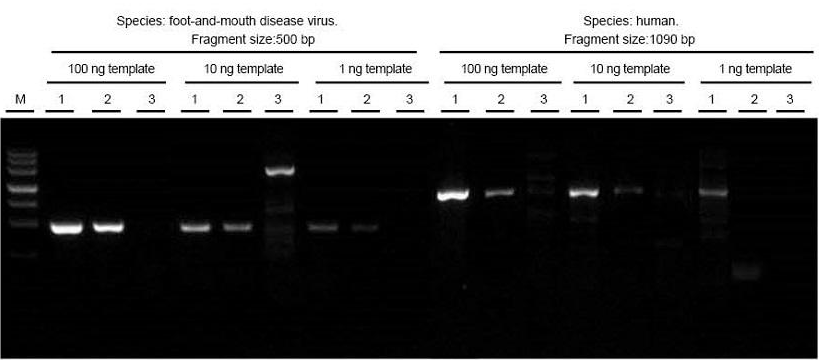 |
Suu- ja sorkkatautiviruksen kokonais-RNA ja ihmisen kudosnäytteet uutettiin vastaavasti. Käännä transkripti ja PCR eri pituiset kohdefragmentit käyttämällä TIANGEN FastKing One Step RT-PCR Kit -laitetta (1), asiaankuuluvia tuotteita toimittajalta A (2) ja toimittajalta B (3) ja tarkkaile PCR-tuotteita elektroforeesin jälkeen. Tulokset osoittavat, että FastKing One Step RT-PCR -sarjan kaista on selkeä ja kirkas, ilman häntää ja ei-spesifisiä nauhoja, ja 1 ng-malli voidaan tunnistaa hyvin. TIANGENin kokeelliset tulokset ovat parempia kuin vastaavien tuotteiden tulokset. |
A-1 RNA hajoaa
- Puhdista korkealaatuinen RNA ilman saastumista. Materiaalin, josta RNA uutetaan, tulee olla mahdollisimman tuoretta RNA: n hajoamisen estämiseksi. Analysoi RNA: n eheys denaturoidulla geelillä ennen RT -reaktiota. RNA -uuton jälkeen se on säilytettävä 100% formamidissa. Jos käytetään RNaasi -inhibiittoria, lämmityslämpötilan tulee olla <45 ° C ja pH: n alle 8,0, muuten estäjä vapauttaa kaiken sitoutuneen RNaasin. Lisäksi RNaasi -inhibiittoria tulee lisätä liuoksiin, jotka sisältävät ≥ 0,8 mM DTT: tä.
A-2-RNA sisältää käänteiskopioijareaktioiden estäjiä
—— Käänteiskopioinnin estäjiä ovat SDS, EDTA, glyseroli, natriumpyrofosfaatti, spermidiini, formamidi, guanidiinisuola jne. Sekoita kontrolli -RNA näytteen kanssa ja vertaa saantoa kontroll -RNA -reaktioon tarkistaaksesi, onko inhibiittoria. Pese RNA -saostus 70% (tilavuus/tilavuus) etanolilla estäjien poistamiseksi.
A-3 cDNA: n ensimmäisen juosteen syntetisointiin käytettyjen alukkeiden riittämätön hehkutus
——Varmista, että hehkutuslämpötila on sopiva kokeessa käytetyille alukkeille. Satunnaisille heksameereille on suositeltavaa pitää lämpötila 25 ° C: ssa 10 minuuttia ennen reaktiolämpötilan saavuttamista. Geenispesifisiä alukkeita (GSP) varten kokeile toista GSP: tä tai vaihda oligo (dT)-tai satunnaiseen heksameeriin.
A-4 Pieni määrä alkavaa RNA: ta
- Lisää RNA: n määrää. Alle 50 ng RNA -näytteille 0,1 μg - 0,5 μg asetyyli -BSA: ta voidaan käyttää ensimmäisen juosteen cDNA -synteesissä
A-5 Kohdesekvenssiä ei ekspressoida analysoiduissa kudoksissa.
- Kokeile muita kudoksia.
A-6 PCR-reaktio epäonnistuu
—— Kaksivaiheisessa RT-PCR: ssä cDNA-malli PCR-vaiheessa ei saa ylittää 1/5 reaktiotilavuudesta.
A-1 Alukkeiden ja mallien epäspesifinen hehkutus
-Alukkeiden 3'-pään ei pitäisi sisältää 2-3 dG tai dC. Käytä geenispesifisiä alukkeita ensimmäisen juosteen synteesissä satunnaisten alukkeiden tai oligon (dT) sijasta. Käytä korkeampaa hehkutuslämpötilaa ensimmäisten syklien aikana ja sitten matalampaa hehkutuslämpötilaa. Käytä kuumakäynnistys Taq DNA -polymeraasia PCR: lle parantaaksesi reaktion spesifisyyttä.
A-2 Geenispesifisten alukkeiden huono suunnittelu
—— Noudata samoja periaatteita monistusalukkeen suunnittelussa.
A-3 RNA, joka on kontaminoitu genomisella DNA: lla
—— Käsittele RNA: ta PCR-luokan DNaasi I: llä. Suorita kontrollireaktio ilman käänteistranskriptiota DNA-kontaminaation havaitsemiseksi.
A-4 Alukedimeerin muodostaminen
—— Suunnittele alukkeet ilman komplementaarisia sekvenssejä 3' -päässä.
A-5 Liian korkea Mg2+ keskittymistä
- Optimoi Mg2+ pitoisuus kullekin templaatin ja alukkeen yhdistelmälle
A-6 Saastunut vieraalla DNA: lla
-Käytä aerosoleja kestäviä kärkiä ja UDG-entsyymejä.
A-1 Ensimmäisen säikeen tuotteen sisältö on liian korkea
- Vähennä ensimmäisen juosteen määrää perinteisessä PCR -reaktiovaiheessa.
A-2 Liian suuri alukemäärä PCR-reaktiossa
- Vähennä alukkeen syöttöä.
A-3 Liian monta sykliä
—— Optimoi PCR -reaktio -olosuhteet ja vähennä PCR -syklien määrää.
A-4 Liian alhainen hehkutuslämpötila
——Korota hehkutuslämpötilaa estämään epäspesifinen käynnistyminen ja laajentuminen.
A-5 Oligonukleotidifragmenttien epäspesifinen monistus, joka syntyy DNA: n DNaasin hajoamisen seurauksena--Uuta korkealaatuista RNA: ta DNA-kontaminaation estämiseksi.
RT-PCR on käänteiskopioida RNA cDNA: ksi ja käyttää sitten käänteistranskriptoitua cDNA: ta templaattina PCR-reaktiolle kohdefragmentin monistamiseksi. Valitse joko satunnaisalukkeet, Oligo dT ja geenispesifiset alukkeet kokeen erityisten olosuhteiden mukaan. Kaikkia edellä mainittuja alukkeita voidaan käyttää lyhyen eukaryoottisolun mRNA: han ilman hiusneularakennetta.
Satunnaisaluke: Sopii pitkälle RNA: lle, jossa on hiusneularakenne, sekä kaikenlaiseen RNA: han, kuten rRNA, mRNA, tRNA jne. Niitä käytetään pääasiassa yksittäisen templaatin RT-PCR-reaktioon.
Oligo dT: Sopii RNA: lle, jossa on PolyA -pyrstö (prokaryoottisessa RNA: ssa, eukaryoottisessa Oligo dT rRNA: ssa ja tRNA: ssa ei ole PolyA -häntä). Koska Oligo dT on sitoutunut PolyA-häntään, RNA-näytteiden laadun on oltava korkea, ja jopa pieni määrä hajoamista vähentää suuresti täyspitkän cDNA-synteesin määrää.
Geenispesifinen aluke: täydentää templaattisekvenssiä, sopii tilanteisiin, joissa kohdesekvenssi tunnetaan.
On kaksi tapaa:
1. Sisäinen vertailumenetelmä: Teoriassa cDNA on eripituisia DNA -fragmentteja, joten elektroforeesin tulos on tahra. Jos RNA: n runsaus on alhainen, mikään tuote ei näy elektroforeesissa, mutta tämä ei tarkoita, ettei PCR: llä monisteta mitään tuotetta. Yleensä sisäistä viitettä voidaan käyttää cDNA: n havaitsemiseen. Jos sisäisellä vertailulla on tuloksia, cDNA: n laatu voidaan periaatteessa taata (joissakin tapauksissa, jos kohdegeenifragmentti on liian pitkä, voi olla poikkeuksia).
2. Jos tällä templaatilla on tunnettu geeni, se voidaan vahvistaa tämän geenin alukkeilla. Sisäisen viittauksen vahvistaminen ei välttämättä tarkoita, että cDNA: lla ei ole ongelmia. Koska sisäisellä viittauksella on runsaasti cDNA: ta, sitä on helppo monistaa. Jos cDNA hajoaa osittain eri syistä, todennäköisyyden näkökulmasta pienen määrän kohdegeenien PCR -tulokset vaikuttavat suuresti. Vaikka sisäistä vertailukelpoisuutta on edelleen runsaasti, vahvistus ei todennäköisesti vaikuta.
Hajoaa osittain RNA: ta. Tunnista RNA: n eheys ja puhdista se
Eri lajien RNA -pitoisuudet voivat olla erilaisia, mutta yleensä uutetun kokonais -RNA: n tulisi sisältää kaksi selkeää 28S- ja 18S -kaistaa geelelektroforeesissa, ja edellisen kaistan kirkkauden tulisi olla kaksi kertaa korkeampi kuin jälkimmäisen. 5S -kaista osoittaa, että RNA on hajonnut ja sen kirkkaus on verrannollinen hajoamisasteeseen. Sisäisen referenssin onnistunut monistaminen ei tarkoita, että RNA: lla ei olisi ongelmia, koska sisäistä viittausta on runsaasti, RNA: ta voidaan monistaa niin kauan kuin hajoaminen ei ole vakavaa. OD260/OD280spektrofotometrillä mitatun puhtaan RNA: n suhteen tulisi olla 1,9 - 2,1. Pieni määrä proteiiniepäpuhtautta RNA: ssa pienentää suhdetta. Niin kauan kuin arvo ei ole liian pieni, RT ei vaikuta. RT: n kannalta tärkeintä on RNA: n eheys.
Sisäisen vertailugeenin pidennys voi vain osoittaa, että RT on onnistunut, mutta se ei välttämättä liity cDNA -juosteen laatuun. Koska sisäiset viitefragmentit ovat yleensä kooltaan pieniä ja ilmentäviä, ne ovat helpompia menestyä käänteiskopioinnissa. Kohdegeenin koko ja ilmentyminen vaihtelee kuitenkin geenistä toiseen. CDNA: n laatua ei voida arvioida pelkästään sisäisen viittauksen avulla erityisesti yli 2 kb: n kohdefragmenteille.
Joillakin näytteillä on monimutkaisia toissijaisia rakenteita tai niissä on runsaasti GC -sisältöä tai ne ovat arvokkaita ja vähäisiä. Näissä tapauksissa sopiva käänteistranskriptaasi tulisi valita kohdefragmentin ja näytteen koon mukaan. RNA -malleille, joilla on korkea GC -pitoisuus ja monimutkainen toissijainen rakenne, on vaikea avata toissijaista rakennetta alhaisessa lämpötilassa tai tavallisella käänteistranskriptaasilla. Näille malleille voidaan valita Quant-käänteistranskriptaasi, koska sen käänteiskopiointitehokkuus on selvästi parempi kuin M-MLV-sarjan käänteiskopioijaentsyymin, joka voi kääntää eri RNA-templaatit tehokkaasti käänteiskopioimiseksi ja transkriptoida RNA: n cDNA-ensimmäiseen juosteeseen mahdollisimman suuressa määrin. Kun käytetään yleistä käänteiskopioijaentsarjaa, 20 μl järjestelmä voi tehokkaasti kääntää vain 1 μg koko RNA: ta. Huomioi sarjan suurin RT -kapasiteetti. Jos templaattia lisätään liikaa, käänteistranskriptio suosii suurta RNA: ta. Siksi on parempi olla ylittämättä järjestelmän enimmäiskapasiteettia.
A-1 Määritä, hajoaako RNA vakavasti ja onko RT onnistunut
Yleensä sisäisen referenssivahvistuksen epäonnistumisen syy johtuu usein vakavasta RNA: n hajoamisesta. Toinen mahdollinen syy on käänteistranskription epäonnistuminen. Sisäistä viitettä ei voida käyttää standardina yksisäikeisen cDNA: n laadun arvioimiseksi, mutta sitä voidaan käyttää standardina sen arvioimiseksi, onko käänteistranskriptio onnistunut, jos RNA: n laadussa ei ole ongelmia. Tärkeintä käänteistranskriptioprosessissa on ylläpitää vakio lämpötila ja vakaa reaktiojärjestelmä reaktion tehokkuuden parantamiseksi.
A-2 Selvitä, ovatko alukkeet sisäisten vertailugeenien monistamiseen luotettavia ja onko PCR-reaktioissa käytettyjä reagensseja ongelmia.
Suhteellista kvantifiointia varten RNA on määritettävä ennen käänteistä transkriptiota, mikä vaaditaan myös monissa käänteistranskriptiopakkauksissa, esimerkiksi RNA -tulon kvantifiointi 1 μg. Koska käänteiskopioitu cDNA on sekoitettu liuos, joka sisältää RNA: n, oligo dT: n, entsyymin, dNTP: n ja jopa pienen DNA -jäännöksen, poikkeama aiheutuu, joten cDNA: n tarkkaa määrittämistä on mahdotonta. Siksi RNA: n kvantifiointi on tarpeen. Koska käänteiskopiointitehokkuus on sama eri näytteiden kesken, saadun cDNA -määrän tulisi olla sama, ja kvantitatiivinen analyysi voi osoittaa eri geenien ilmentymistasojen vertailun samassa kokonais -RNA -määrässä. Suorittaessa suhteellista fluoresenssikvantitatiivista PCR: ää, kvantitatiivista cDNA: ta ei ehkä vaadita käänteiskopioinnin jälkeen, koska sisäistä vertailugeeniä voidaan käyttää vertailuna.
Se liittyy pääasiassa geeneihin, ja pitkän fragmentin käänteistranskriptio ei ole mahdollista useimmille geeneille. Ensinnäkin käänteistranskription tehokkuus on paljon alhaisempi kuin PCR: n. Toiseksi GC -rikas alue ja monien geenien toissijainen rakenne rajoittavat sekä käänteistranskriptiota että PCR: ää. Lopuksi PCR: n tarkkuutta ja monistustehokkuutta on vaikea taata samanaikaisesti. Käänteiskopiointiprosessissa kukaan ei voi taata pitkän fragmentin saamista alhaisen kopion geeneille, erityisesti oligo dT: tä käyttämällä. Mitä tulee 5 'UTR: iin, jossa on enemmän GC: tä, se on vielä vaikeampaa. Siksi on edelleen kohtuullinen menetelmä kääntää transkriptio satunnaisalukkeilla, löytää kohdefragmentin luonnolliset pilkkomiskohdat, monistaa segmenteillä ja suorittaa sitten restriktiohajotus ja ligaatio. Yleensä on vaikeaa monistaa suoraan yli 2 kb: n fragmentteja, mutta ei aina ole mahdotonta saada: 1. Ensinnäkin taata RNA/mRNA: n eheys, ja TRIZOL -uutto on edullista. 2.M-MLV RT-PCR -sarjaa voidaan käyttää suoraan. Pidennä hehkutusaikaa ja lisää syklien määrää vahvistusprosessissa oikein. Vaihtoehtoisesti voidaan käyttää sisäkkäistä PCR: ää tai suorittaa yksi tai kaksi reaktiota ensin pidentämällä sopivasti denaturointia ja pidennysaikaa ennen normaalia PCR -monistusta, mikä voi auttaa pidentämään fragmentteja. Kiinnitä huomiota polymeraasin tarkkuuteen. 3.Long Taqia voidaan käyttää PCR: ssä ihanteellisten tulosten saamiseksi. 4.Proteiiniekspressiosovelluksessa tulee käyttää korkean tarkkuuden polymeraasia.
TIANGEN tarjoaa kahdenlaisia käänteiskopioijaentsyymejä: Quant/King RTase ja TIANScript M-MLV. Suurin ero niiden välillä on mallien syöttömäärä. Quant on ainutlaatuinen käänteiskopioijaentsyymi, joka eroaa yleisesti käytetystä Moloney-hiiren leukemiaviruksesta peräisin olevasta M-MLV: stä. Quant on uusi korkean hyötysuhteen käänteiskopioijaentsyymi, jota ilmentää rekombinanttisesti Escherichia coli. Quant soveltuu 50 ng-2 μg RNA: n monistamiseen suurella käänteistranskription aktiivisuudella ja suurella saannolla. Tavalliseen MMLV: hen tai AMV: hen verrattuna Quantin suurin ominaisuus on, että sillä on erittäin vahva affiniteetti RNA -malleihin ja se voi kääntää transkriptiompleksimallit ilman korkean lämpötilan denaturointia. Mallien, joissa on korkeampi GC -sisältö, käänteinen hyötysuhde on suurempi. Tällä käänteiskopioijaentsyymillä on kuitenkin RNaasi H -aktiivisuutta, joka voi vaikuttaa cDNA -tuotteen pituuteen (sopii <4,5 kb: n templaateille). Perinteiseen käänteistranskriptioon suositellaan TIANScript MMLV -käänteiskopioijaentsyymiä. Tämä RTaasi on modifioitu entsyymi, jolla on erittäin heikko RNaasi H -aktiivisuus, ja joka soveltuu pitkälle (> 5 kb) cDNA -synteesille.
Yksivaiheinen käänteiskopiointi ja PCR-monistus suoritetaan samassa putkessa avaamatta putken kantta cDNA-synteesin ja monistuksen välillä, mikä auttaa vähentämään kontaminaatiota. Koska kaikkia saatuja cDNA -näytteitä käytetään monistamiseen, herkkyys on suurempi, vähintään 0,01 pg RNA: ta. Onnistuneessa yksivaiheisessa RTPCR: ssä käytetään yleensä geenispesifisiä alukkeita cDNA-synteesin aloittamiseksi. Kaksivaiheinen menetelmä, nimittäin käänteiskopiointi ja PCR-monistus, suoritetaan kahdessa vaiheessa. Ensiksi käänteiskopiointi suoritetaan RNA -templaatista cDNA: n saamiseksi, ja saatu cDNA altistetaan yhdelle tai useammalle erilaiselle PCR -reaktiolle. Kaksivaiheinen menetelmä voi käyttää oligo (dT)-tai satunnaisia alukkeita ohjaamaan cDNA: n ensimmäisen juosteen synteesiä, ja se voi käänteiskopioida kaikki mRNA-tiedot tietystä näytteestä.
Tuoteryhmät
MIKSI VALITA MEIDÄT
Tehtaamme on perustamisestaan lähtien kehittänyt maailmanluokan tuotteita periaatteen mukaisesti
ensin laatu. Tuotteemme ovat saaneet erinomaisen maineen alalla ja arvostusluottamuksen uusien ja vanhojen asiakkaiden keskuudessa.